ชนิดของผลึกของแข็ง
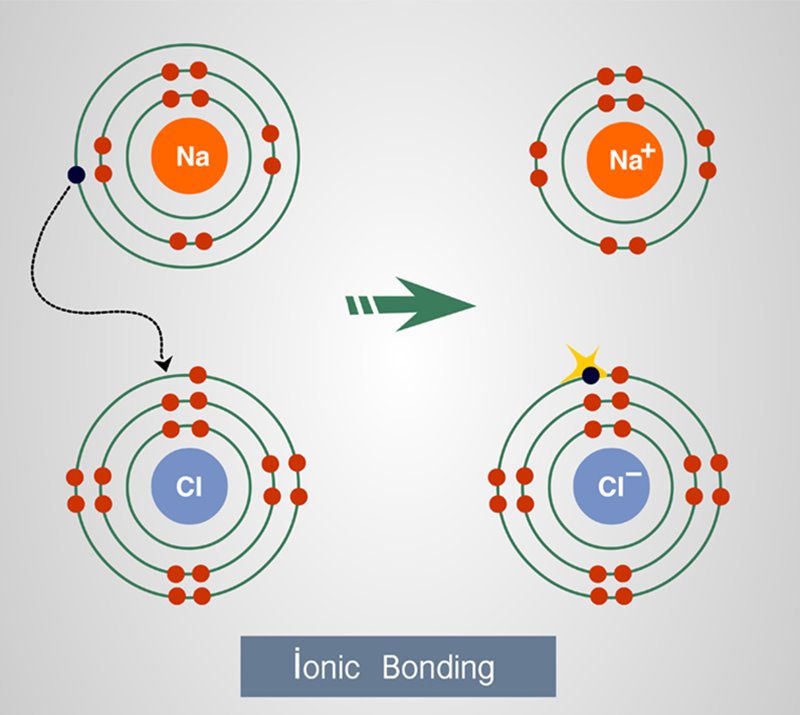
1. ผลึกไอออนิก (Ionic
crystal) อนุภาคของผลึกประเภทนี้จะเป็นไอออนบวกและไอออนลบเรียงตัวสลับกันไปในลักษณะสามมิติ
แข็งแต่เปราะ มีจุดหลอมเหลวแลจุดเดือดสูง
ขณะเป็นของแข็งไม่นำไฟฟ้าแต่เมื่อหลอมเหลวหรืออยู่ในรูปสารละลายจะสามารถนำไฟฟ้าได้
ตัวอย่างที่พบบ่อยๆ ได้แก่ สารประกอบออกไซด์ของโลหะหมู่ 1 และหมู่ 2
เกลือเฮไลด์ของโลหะ
2. ผลึกโมเลกุล (Molecular
crystal) อนุภาคของผลึกประเภทนี้อาจเป็นอะตอมหรือโมเลกุล
แรงดึงดูดระหว่างอนุภาคอาจเป็นแรงดึงดูดระหว่างขั้วของโมเลกุล
หรือเป็นแรงแวนเดอร์วาลส์ ผลึกประเภทนี้ค่อนข้างอ่อนหรือนิ่ม เช่น ผลึกของไอโอดีน
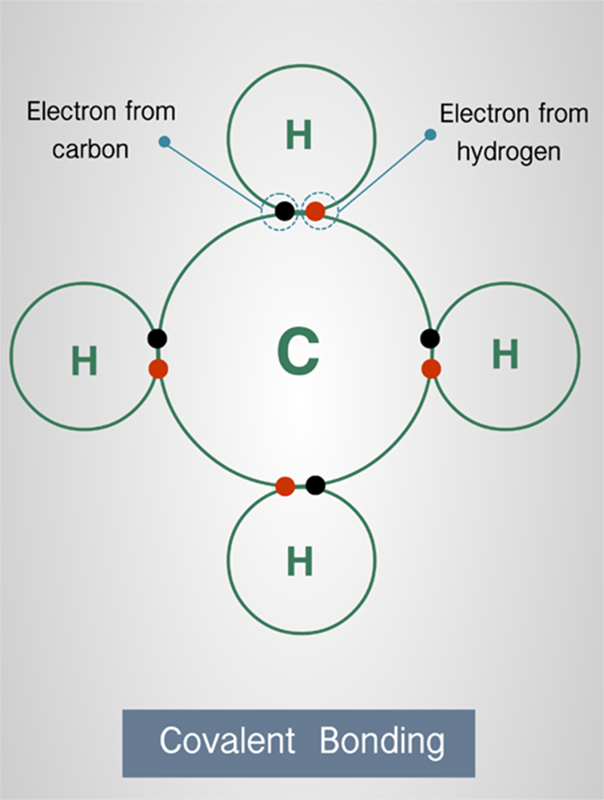
3. ผลึกโคเวเลนต์ร่างตาข่าย (Covalent crystal) อนุภาคของผลึกประเภทนี้จะเป็นอะตอม
มีการยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เช่น เพชร
อะตอมองค์ประกอบแต่ละอะตอมจะยึดเหนี่ยวกับอะตอมข้างเคียงสีอะตอมด้วยพันธะโคเวเลนต์ที่แข็งแรง
ผลึกประเภทนี้มีจุดหลอมเหลวและจุดเดือดที่สูงมาก มีความดันไอต่ำ
และไม่ละลายตัวในสารละลายใดๆ ตัวอย่างที่พบบ่อยๆ คือ เพชร และแกรไฟต์
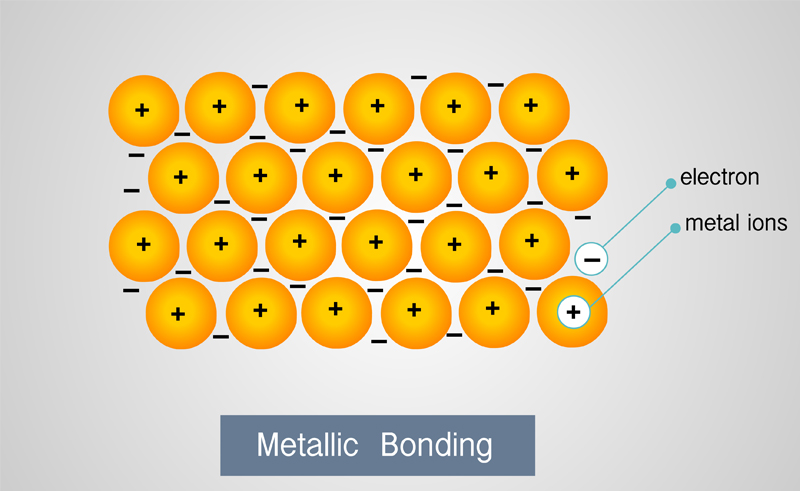
4. ผลึกโลหะ(Metallic
crystal) อนุภาคของผลึกประเภทนี้จะเป็นไอออนบวกที่อยู่ท่ามกลางเวเลนต์อิเล็กตรอนแต่ละอิเล็กตตรอนเคื่อนที่ได้อย่างอิสระทั่วทั้งก้อนของโลหะผลึกประเภทนี้มีจุดเดือดและจุดหลอมเหลวสูง
ดึงให้เป็นแผ่นและตีเป็นเส้นได้ง่าย ตตัวอย่าง โลหะโดยทั่วไป เช่น เหล็ก เงิน
และทองคำ เป็นต้น
คุณสมบัติของแข้ง ของเหลว แก๊ส
ของแข็ง
1.
ของแข็งที่มีลักษณะเป็นผลึก (crystalline
solid)
สารบางอย่างอาจมีรูปผลึกได้หลายแบบซึ่งเราจะเรียกว่า ปรากฏการณ์อัญรูป
(polymorphism)
สารบางชนิดอาจจะมีรูปร่างผลึกที่เหมือนกันได้
ซึ่งจะเรียกปรากฏการณ์นี้ว่า
ภาวะรูปร่างเหมือน (isomorphism) นอกจากนี้
ผลึกยังมีสมบัติที่เรียกว่า anisotropy
อันได้แก่ความแข็งแรงทนทานทางกล
ดรรชนีหักเห และการนําไฟฟ้า ถ้าวัดในทิศทางที่ต่างกันค่าที่ได้จะไม่เท่ากัน
2. ของแข็งอสัณฐาน
(aorphous solid)
ของแข็งที่อนุภาคอยู่ปะปนกันอย่างไม่เป็นระเบียบ ไม่มีรูปร่างที่แน่นอน
มีสมบัติทั่วๆ ไปคล้ายผลึก
แตกต่างกันที่ไม่มีรูปทรงเรขาคณิตที่แน่นอน ดังนั้นจึงมีสมบัติที่เรียกว่า isotropy คือ ค่าดรรชนีหักเห การนําไฟฟ่า นอกจากนี้ของแข็งอสัณฐานจะมีจุดหลอมเหลวไม่เด่นชัด
ของเหลว
1. ความตึงผิว โมเลกุลที่อยู่ตรงกลางได้รับแรงดึงดูดจากโมเลกุลอื่นที่อยู่ล้อมรอบเท่ากันทุกทิศทุกทาง
ส่วนโมเลกุลที่ผิวหน้าจะได้รับแรงดึงดูดจากโมเลกุลที่อยู่ด้านล่างและด้านข้างเท่านั้น
โมเลกุลที่ผิวหน้าจึงถูกดึงเข้าภายในของเหลว
ทำให้พื้นที่ผิวของของเหลวลดลงเหลอน้อยที่สุด จะ
ของเหลวพยายามจัดตัวเองให้มีพื้นที่ผิวน้อยที่สุด
เนื่องจากโมเลกุลที่ผิวไม่มีแรงดึงเข้าทางด้านบน
จึงมีเสถียรภาพน้อยกว่าโมเลกุลที่อยู่ตรงกลาง
การลดพื้นที่ผิวเท่ากับเป็นการลดจำนวนโมเลกุลที่ผิวหน้า
จึงทำให้ของเหลวเสถียรมากขึ้นในบางกรณีของเหลวมีความจำเป็นต้องเพิ่มพื้นที่ผิว
โดยที่โมเลกุลที่อยู่ด้านในของของเหลวจะเคลื่อนมายังพื้นผิว
2. การระเหย (Evaporation) คือ
เนื่องจากโมเลกุลของของเหลวเคลื่อนที่อยู่ตลอดเวลา
ซึ่งแต่ละโมเลกุลเคลื่อนที่ด้วยความเร็วไม่เท่ากัน
ดังนั้นการเคลื่อนที่ของโมเลกุลอาจมีการขนกันและมีการแลกเปลี่ยนพลังงานกันได้ทำให้โมเลกุลหนึ่ง
ๆ อาจได้รับพลังงานเพิ่มขึ้น และบางโมเลกุลสูญเสียพลังงานลงไป
ถ้าโมเลกุลที่มีพลังงานจลน์สูง ๆ อยู่ที่บริเวณผิวของของเหลว
ก็สามารถชนะแรงดึงดูดระหว่างโมเลกุลได้ก็จะหลุดออกไป
โมเลกุลที่หลุดออกจากผิวหน้าของของเหลวและอยู่ในสถานะก๊าซ
เรียกกระบวนการดังกล่าวนี้ว่า การระเหย ( Evaporation )
3. ความดันไอ (vapor pressure) คือ
เมื่อใส่ของเหลวไว้ในระบบปิด
โมเลกุลของของเหลวที่มีพลังงานมากและชนะแรงดึงดูดระหว่างโมเลกุลด้วยกัน
ก็จะระเหยกลายเป็นไอ
โมเลกุลของไอที่อยู่เหนือผิวของเหลวนั้นจะชนกันเอง
ชนกับผิวของภาชนะบ้าง และควบแน่นกลับมาเป็นของเหลวบ้าง
เมื่อของเหลวระเหยกลายเป็นไอเพิ่มขึ้นจนถึงจำนวนหนึ่งจะทำให้ไอนั้นมีความดันค่าหนึ่งจนคงที่
ณ ความดันไอที่คงที่นี้จะมีจำนวนโมเลกุลของไอเหนือขงเหลวมีค่าเท่าเดิมอยู่ตลอดเวลา
เรียกว่า ภาวะสมดุล ที่ภาวะสมดุล จำนวนโมเลกุลของของเหลวที่ระเหยไปเป็นไอ
และจำนวนโมเลกุลของไอที่ควบแน่นกลับมาเป็นของเหลวเท่ากันตลอดเวลา ที่ภาวะสมดุลใด ๆ
ที่ยังมีการเปลี่ยนแปลงกลับไปกลับมาได้ตลอดเวลา
ด้วยอัตราเร็วเท่ากันและผลของการเปลี่ยนแปลง ระบบมีสมบัติคงที่ เรียกว่า
สมดุลไดนามิก ความดันไอที่อยู่เหนือของเหลว ณ ภาวะสมดุลนี้เรียกว่า ความดันไอ ( Vapor pressure
)
4. จุดเดือด การเดือด ( Boiling
) เป็นขบวนการที่โมเลกุลของของเหลวได้รับพลังงานสูง
การเดือดของของเหลวจะเกิดขึ้นที่อุณหภูมิหนึ่ง ซึ่งจะคงที่สำหรับของเหลวแต่ละชนิด
เรียกว่า จุดเดือด(Boiling point) ความดันไอของของเหลวขณะเดือดจะมีค่าเท่ากับความดันภายนอกหรือมากกว่าซึ่งก็คือความดันบรรยากาศขณะนั้น
ความดันของบรรยากาศจะมีผลต่อจุดเดือดของของเหลว คือ ถ้าเปลี่ยนความดันจะทำให้จุดเดือดของของเหลวเปลี่ยนไป
แก๊ส
1.
แก๊สมีรูปร่างเป็นปริมาตรไม่แน่นอน เปลี่ยนแปลงไปตามภาชนะที่บรรจุ บรรจุ
2.
ถ้าให้แก๊สอยู่ในภาชนะที่เปลี่ยนแปลงปริมาตรได้
ปริมาตรของแก๊สจะขึ้นอยู่กับอุณหภูมิ ความดันและจำนวนโมล
3.
สารที่อยู่ในสถานะแก๊สมีความหนาแน่นน้อยกว่าเมื่ออยู่ในสถานะของเหลวและของแข็ง
4.
แก๊สสามารถแพร่ได้
และแพร่ได้เร็วเพราะแก็สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าของเหลวและของแข็ง
5. แก็สต่างๆ
ตั้งแต่ 2 ชนิดขึ้นไปเมื่อนำมาใส่ในภาชนะเดียวกัน
แก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน นั้นคือส่วนผสมของแก๊สเป็นสารเดียว
หรือเป็นสารละลาย (Solution)
6.
แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส
ทฤษฎีจลน์ของแก๊ส
1.ก๊าซประกอบด้วยโมเลกุลที่มีขนาดเล็กมากอยู่ห่างกัน
และไม่มีแรงยึดเหนี่ยวระหว่างกัน
2.
แต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลาด้วยอัตราเร็วคงที่
(แต่ไม่จำเป็นต้อง เท่ากัน) จนกระทั่งชนกันเองหรือชนผนังภาชนะที่บรรจุ
จึงจะเปลี่ยนทิศทางและอาจเปลี่ยนอัตราเร็วด้วย
เมื่ออุณหภูมิคงที่อัตราเร็วเฉลี่ยของโมเลกุลของก๊าซชนิดหนึ่ง ๆ จะ คงที่
3.โมเลกุลของก๊าซมีพลังงานจลน์ค่าหนึ่ง เท่ากับ
1/2 mV2 เมื่อ m คือ มวลของโมเลกุล และ V คือ อัตราเร็วในการเคลื่อนที่ของโมเลกุล
4.เมื่อโมเลกุลชนกันหรือชนผนังภาชนะ
อาจจะมีการถ่ายพลังงาน แต่ไม่มีการสูญเสีย พลังานรวม
5.ที่อุณหภูมิเดียวกัน
ก๊าซทุกชนิดจะมีพลังงานจลน์เฉลี่ยเท่ากัน พลังงานจลน์เฉลี่ยของก๊าซ
จะแปรผันตรงกับอุณหภูมิเคลวิน ก๊าซที่มีสมบัติครบถ้วนตามทฤษฎีจลน์เรียกว่า
ก๊าซสมบูรณ์ ซึ่งไม่มีจริง ก๊าซจริงอาจมี สมบัติใกล้เคียงกับก๊าซสมบูรณ์ได้
ถ้าอยู่ในระบบที่อุณหภูมิสูงและความดันต่ำ ก๊าซ
ส่วนใหญ่โดยเฉพาะก๊าซเฉื่อยที่อุณหภูมิห้อง ความดัน 1 บรรยากาศ มีสมบัติใกล้เคียง
กับก๊าซสมบูรณ์
แหล่งอ้างอิง:https://sites.google.com/site/sciencenarumon/home/khunsmbati-khxng-khxngkhaeng-khxnghelw-kaes